Enfoque integrado para realizar pruebas a pacientes con trastornos del espectro autista
La importancia de evaluar la inflamación, las infecciones y los trastornos gastrointestinales en pacientes con Trastornos del Espectro Autista (TEA)

TANJA MIJATOVIC, PHD R.E.D. CSO DE LABORATORIO Y RESPONSABLE DE LABORATORIO
Diagnóstico de autismo



Disfunción inmune en el autismo
La importancia de evaluar la inflamación, las infecciones y los trastornos gastrointestinales en pacientes con trastornos del espectro autista (TEA)

Inflamación y TEA: un problema bien documentado



Disfunción inmune en el autismo:
Un camino hacia el tratamiento
“El autismo es un trastorno complejo y clínicamente heterogéneo con un espectro de síntomas. Los hallazgos publicados han identificado cambios generalizados en el sistema inmunológico de niños con autismo, tanto a nivel sistémico como celular. En conjunto, estos informes sugieren que el autismo puede ser, de hecho, un trastorno sistémico con conexiones con respuestas inmunes anormales. Esta disfunción del sistema inmunológico puede representar nuevos objetivos de tratamiento”. (Careaga et al. Neuroterapéutica 2010)
El diagnóstico de autismo adolece de la falta de un biomarcador específico
Varias vías bioquímicas están asociadas con los TEA
Actualmente hay muchos paneles de pruebas disponibles para la evaluación biomédica de afecciones multifactoriales.
Los trastornos del espectro autista son incluso más complejos que la mayoría de los síndromes multifactoriales, por lo que necesitan un enfoque muy especializado y personalizado.

Inmunidad

Inmunidad innata y adquirida

Disfunción inmune

Hallazgos inmunológicos en ASD

HUGHES Y OTROS. FRENTE. CÉLULA. NEUROCIENCIA., 13 DE NOVIEMBRE DE 2018
La mayoría de los niños con autismo mostraron una baja actividad de las células nk
Recuento absoluto de células asesinas naturales CD56+ y CD57+
Vojdani et al (J Neuroimmunol. 2008) informaron sobre la baja actividad citotóxica de las células asesinas naturales en el autismo. En su estudio, que incluyó 1.027 muestras de sangre de niños autistas obtenidas de diez clínicas y comparó los resultados con 113 controles sanos, el 45% de los niños con autismo exhibieron una baja actividad de las células NK.
Las células CD57+/CD3- son un subconjunto de células NK. No se comprende bien su función exacta y qué las diferencia de las células NK CD56+. El número absoluto de células CD57+/CD3- es bajo en pacientes que padecen la enfermedad de Lyme crónica (una enfermedad que sigue a una infección por una bacteria llamada Borrelia). Los pacientes con CD57 muy bajo tienen significativamente más coinfecciones y defectos inmunológicos persistentes que los pacientes con recuentos más altos. En pacientes que responden a la terapia con antibióticos, el número de células vuelve a la normalidad, por lo que es un marcador útil para seguir el efecto de una terapia.
Nuestro estudio (Siniscalco et al, InVivo 2016) mostró que de 107 pacientes autistas inscritos, 73 (68,2%) de ellos mostraron CD57 por debajo de 100 células/μl de sangre completa (media ± EE 49,12 ± 3,12), y entre ellos 47 (64,4 %) de los pacientes mostraron CD57 por debajo del límite inferior del rango normal (el rango normal se considera 60-360 células/μl de sangre completa).


Expresión de ARNm de perforina: un medio para evaluar la activación de las células nk
Expresión de ARNm de perforina: un medio para evaluar la activación de las células nk
Las células Nk ejercen su efecto citotóxico liberando perforina, una proteína que destruirá la membrana citoplasmática de las células diana y finalmente las matará.
Un aumento de perforina indica que hay una infección, mientras que un nivel bajo de perforina indicaría una infección viral persistente y en curso.
Inflamación
La respuesta de nuestra inmunidad natural al estrés se llama
Los neutrófilos y macrófagos se congregan en el sitio de lesión/infección.
Fagocitan invasores y liberan sustancias tóxicas como radicales de oxígeno.
Los macrófagos liberan citocinas proinflamatorias IL-6 y TNFalfa para organizar una respuesta inflamatoria adicional.
Los mastocitos y eosinófilos se involucrarán en la defensa parasitaria y la alergia.
Las células asesinas naturales eliminan las células no propias liberando sustancias tóxicas.


Respuesta inmune
Respuesta inmune celular Th1
Así es como eliminamos los patógenos intracelulares y las células no autólogas.
Respuesta inmune humoral Th2
Esta es nuestra capacidad para producir anticuerpos para neutralizar patógenos.
¡Th1 y Th2 siempre deben estar en equilibrio!
Inmunidad específica
Th1 y Th2 producen y liberan citocinas que desencadenan un efecto dominó que conduce a una reacción inmunológica:
Las citocinas liberadas por Th1 son: IL-2, IL-12, INFɣ, INFα y INFβ
Las citocinas liberadas por Th2 son: IL-4, IL-5, IL-10
Las citocinas Th1 suprimen las citocinas Th2 y viceversa
Si el patógeno es derrotado, el sistema inmunológico vuelve a un equilibrio entre Th1 y Th2
Desafortunadamente, algunas condiciones implican la activación crónica o la supresión de una de las dos categorías.


Equilibrio TH1/TH2
Prueba de equilibrio TH1/TH2 basada en orina
puede detectar disturbios de este delicado equilibrio a tiempo para restablecer el equilibrio cuando sea necesario y antes de que se desarrollen condiciones irreversibles
permite a los pacientes seguir el equilibrio TH1/TH2 durante la terapia (antioxidantes, probióticos, nutracéuticos).

Desequilibrios de citocinas en los trastornos del espectro autista
Ashwood et al. (Brain Behav Immun. 2011) informaron aumentos significativos en los niveles plasmáticos de varias citocinas, incluidas IL-1β, IL-6, IL-8 e IL-12p40 en el grupo con TEA en comparación con los controles.
Suzuki y cols. (PLoS One 2011) informaron que las concentraciones plasmáticas de IL-1β, IL-1RA, IL-5, IL-8, IL-12(p70), IL-13, IL-17 y GRO-α fueron significativamente mayores en los sujetos. con TEA en comparación con los valores correspondientes de controles emparejados.
Okada et al. (Prog Neuropsychopharmacol Biol Psychiatry 2007) y Ashwood et al. (J Neuroimmunol. 2008) informaron sobre niveles séricos reducidos del factor de crecimiento transformante beta1 (TGFb1) en pacientes con autismo, con niveles más bajos de TGFb1 asociados con conductas adaptativas más bajas y peores síntomas conductuales, lo que sugiere que
Al-Ayadhi LY1, Mostafa GA – J Neuroinflamación. 2012 9:158. informaron que los niños con autismo tenían niveles séricos de IL-17A significativamente más altos que los controles sanos (P <0,001), y se encontraron niveles séricos elevados de IL-17A en el 48,9% del grupo con autismo.

Los pacientes con autismo severo tenían niveles séricos de IL-17A significativamente más altos que aquellos con autismo leve a moderado (P = 0,01), y los niveles séricos elevados de IL-17A fueron significativamente más comunes en niños con autismo severo (67,9%) que en aquellos con autismo leve. a autismo moderado (17,6%), p = 0,001.
Los niveles séricos de IL-17A aumentaron en el grupo con autismo y los niveles se correlacionaron significativamente con la gravedad del autismo.
Se justifica realizar más investigaciones para determinar si el aumento de los niveles séricos de IL-17A en plasma tiene un papel patogénico en el autismo y si la terapia anti-IL-17A podría ser útil.
La importancia de evaluar los marcadores relacionados con la inflamación.

MIJATOVIC T. ET AL., 2018, AIMS MOLECULAR SCIENCE 5:173-182.
Producción de Pge2 durante enfermedad y estrés psicológico

Cuantificación

Se ha encontrado que la PGE2 es significativamente más alta en pacientes autistas
Cuantificación de los niveles séricos de Prostaglandina E2
Se ha encontrado que la Prostaglandina E2 (PGE2) es significativamente más alta en pacientes autistas, registrando un aumento del 91.15% (El-Ansary & Al- Ayadhi, Lipids Health Dis. 2012).
La PGE2 es un compuesto derivado de fosfolípidos de membrana y es un mediador clave de la inmunopatología en infecciones crónicas y cáncer
La PGE2 suprime selectivamente las funciones efectoras de los macrófagos y neutrófilos y la inmunidad tipo 1 mediada por células Th1-, CTL- y NK, pero promueve respuestas de células T Th2, Th17 y reguladoras.
La PGE2 modula la producción de quimiocinas, inhibiendo la atracción de células proinflamatorias mientras mejora la acumulación local de células T reguladoras y células supresoras derivadas de mieloides.
Expresión de ARNm de elastasa: un marcador de inflamación

La elastasa es una proteasa inflamatoria expresada en células inmunes (monocitos, neutrófilos) que contribuye a la defensa inmunológica al inactivar bacterias extranjeras, pero al mismo tiempo causa daño al tejido conectivo, descompone citocinas, inmunoglobulinas y receptores de células inmunes. Por lo tanto, una producción excesiva y crónica de elastasa es perjudicial (destrucción de gammaglobulinas➔ disminución de la inmunidad; rotura de elastina➔ disminución de la elasticidad del tejido, problemas con el cuello).
Exposición ambiental y estrés oxidativo
El estrés oxidativo está implicado en un gran número de enfermedades, incluidas enfermedades neurodegenerativas y enfermedades autoinmunes.
Detectan indicadores de estrés oxidativo en músculos y sangre
El daño oxidativo a las membranas celulares puede alterar la permeabilidad de la barrera hematoencefálica, lo que podría provocar algunos de los síntomas cognitivos observados en los pacientes.
El aumento del estrés oxidativo podría tener varios orígenes: inflamación crónica (los neutrófilos activados liberan moléculas prooxidantes), producción excesiva de óxido nítrico (el NO reacciona con los radicales libres para producir peroxinitrito, un potente oxidante) o exposición a toxinas ambientales (la exposición a ciertas sustancias químicas conduce a al agotamiento de antioxidantes esenciales como el glutatión y el selenio; los metales pesados también pueden inhibir directamente enzimas antioxidantes como la superóxido dismutasa o la glutatión reductasa).
Los marcadores de estrés oxidativo son útiles para evaluar la necesidad de una terapia antioxidante.

Resumen: pruebas de disfunciones inmunes y metabólicas

El alcance de las disfunciones inmunes y/o metabólicas globales se evalúa mediante pruebas:
expresión de citoquinas
Expresión de ARNm de elastasa y perforina.
estrés oxidativo, metales pesados, mohos
actividad fagocítica de macrófagos
Actividad alfa-N-acetilgalactosaminidasa (prueba de Nagalase)
expresión sCD14
Expresión C3a y C4a
Recuento absoluto del subconjunto de células CD57
Síntesis de prostaglandina E2 (PGE2) y hsCRP.
Síntesis de VEGF
acumulación de amoníaco
acumulación de ácido quinurénico y quinolínico, y muchos más
Pruebas de disfunción intestinal en el autismo
Aunque el TEA afecta principalmente al cerebro, en los últimos años los vínculos con otros sistemas se han vuelto claros; en particular, los problemas gastrointestinales (GI) parecen ocurrir con más frecuencia en personas con TEA que en el resto de la población.
Los problemas gastrointestinales que acompañan al TEA pueden deberse a dos factores: en primer lugar, una activación inmunitaria inadecuada, que provoca inflamación del tracto; y, en segundo lugar, diferencias en los tipos de bacterias intestinales presentes.

Eje intestino-cerebro en autismo


Disfunciones intestinales en el autismo
La flora intestinal y el estado gastrointestinal en niños con autismo se correlacionan con la gravedad del autismo
Adams y cols. (BMC Gastroenterology 2011) informaron que los síntomas gastrointestinales estaban fuertemente correlacionados con la gravedad del autismo. De los cuatro tipos de bacterias beneficiosas que se investigaron, los niños con autismo tenían niveles mucho más bajos de Bifidobacterium (-45%), niveles ligeramente más bajos de Enterococcus (-16%) y niveles mucho más altos de Lactobacillus (+100%).
Finegold et al. (Anaerobe 2010) informaron que en las heces de los niños de control, Firmicutes representaba el 63,6% de la flora total, pero sólo el 38-39% de la flora de las heces de los niños autistas. Los bacteroidetes representaron el 30% de la flora de las heces en los controles y el 51% en la flora de las heces de los niños autistas. Las actinobacterias constituían el 1,8% de la flora de las heces de los niños de control y entre el 0,4 y el 0,7% de la flora de los niños autistas. Las proteobacterias constituían el 0,5% de la flora de los niños de control y entre el 2,3 y el 3,1% de la flora de los niños autistas. En resumen, la flora fecal de los niños autistas fue estadísticamente significativamente diferente de la flora fecal de los niños sanos.
R.E.D. Laboratories ofrecen pruebas especializadas para analizar en profundidad la microbiota intestinal: ensayo msa
Ensayo metagenómico en heces (MSA)
Análisis de la microbiota intestinal: del cultivo a la secuenciación de alto rendimiento:
Hasta hace poco, la investigación sobre la composición de la microbiota se basaba casi exclusivamente en el cultivo; Entre el 40 y el 80% de las bacterias intestinales no se pueden cultivar
La identificación de colonias puede ser difícil
Las bacterias deben estar vivas: los estudios de anaerobios son muy difíciles, grandes pérdidas durante la recogida y el procesamiento de muestras
El enfoque de cultivo puede abordar sólo una pequeña fracción de todas las especies bacterianas (¿10%?)
E. coli, que alguna vez se pensó que era una especie dominante, es un miembro menor...
Los científicos del R.E.D. Laboratories han desarrollado y validado un nuevo procedimiento para analizar poblaciones bacterianas en una muestra de heces: ensayo MSA
Nueva técnica molecular que implica la secuenciación de regiones específicas del ADN bacteriano (metagenómica)
Se puede realizar en organismos muertos (la exposición al oxígeno y la congelación no son un problema)
Identificación de cada bacteria comparando secuencias con bases de datos públicas: extremadamente precisa, no subjetiva
La tecnología de alto rendimiento permite la identificación de decenas o incluso cientos de miles de organismos en una sola muestra.
La tecnología de alto rendimiento permite la identificación de decenas o incluso cientos de millas de organismos en una sola muestra.


MSA Niño TEA
Prevotella: productores fuertes de azufre de hidrógeno (H2S). En exceso, el H2S actúa como un veneno mitocondrial y un potente neurotóxico. Puede inhibir directamente enzimas involucradas en la producción celular de energía. El H2S también interfiere con el transporte de oxígeno al bloquear la hemoglobina en los glóbulos rojos. Finalmente, el H2S está reduciendo el pH del intestino impidiendo el crecimiento de muchas bacterias beneficiosas.
Bacteroides: bacterias disbióticas encontradas en la mayoría de las infecciones anaeróbicas con una mortalidad asociada de más del 19%. Las especies del género Bacteroides tienen los mecanismos de resistencia a los antibióticos más y las tasas de resistencia más altas de todos los patógenos anaeróbicos.


1ª visita abril 2017: Alto tanto Bacteroides como Prevotella
2ª visita diciembre 2017:Todavía alto Bacteroides pero normalizado Prevotella
3ª visita diciembre 2018:Normalizado tanto Bacteroides como Prevotella
Intestino permeable en niños con TEA


Intestino permeable
Prueba ELISA de ZONULIN en muestras de heces
La zonulina es la “puerta” al intestino permeable. La zonulina abre los espacios entre las células del revestimiento intestinal. Cuando está presente el intestino permeable, los espacios entre las células se abren demasiado, permitiendo que las moléculas de proteínas más grandes y las bacterias entren en el torrente sanguíneo donde puede tener lugar una reacción inmunológica. A medida que aumenta el nivel de zonulina, el sello entre las células intestinales disminuye. La zonulina es el único modulador fisiológico de las uniones estrechas intercelulares descrito hasta ahora que está involucrado en el tráfico de macromoléculas y, por lo tanto, en el equilibrio de la respuesta de tolerancia/inmune.


Consecuencias del intestino permeable: activación crónica (inflamación) del sistema inmunológico
Lipopolisacárido (LPS) - compuesto bacteriano que puede llegar fácilmente a la sangre.
Presente en el torrente sanguíneo, el LPS inducirá una fuerte respuesta proinflamatoria en los monocitos y macrófagos, involucrando el reconocimiento por un receptor (receptor tipo Toll-4) y la secreción subsiguiente de citoquinas como IL-1, IL-6, TNF-alfa.
El LPS también induce la producción de óxido nítrico mediada por NK-kB. Debido a que el NO aumenta, la función de NK se inhibe y a menudo se observan infecciones oportunistas como las infecciones por micoplasma.
Los herpesvirus, que tienden a reactivarse en un contexto de activación inmunológica, también se detectarán con frecuencia.
Consecuencias del intestino permeable

SCD14: un marcador interesante

Los pacientes con autismo severo tuvieron niveles de IL-17A en suero significativamente más altos que aquellos con autismo leve a moderado (P=0.01), y los niveles elevados de IL-17A en suero fueron significativamente más comunes en niños con autismo severo (67.9%) que en aquellos con autismo leve a moderado (17.6%), P=0.001.
Los niveles de IL-17A en suero aumentaron en el grupo con autismo, y los niveles se correlacionaron significativamente con la severidad del autismo
Se justifica una investigación adicional para determinar si el aumento de los niveles de IL-17A en plasma tiene un papel patológico en el autismo, y si la terapia anti-IL-17A podría ser útil.
Metabolitos tóxicos de bacterias
D-lactato en suero
un producto del metabolismo bacteriano, no es producido ni metabolizado por las células de mamíferos. Típicamente, los niveles elevados de D-lactato son debido a una infección bacteriana o síndrome de intestino corto en humanos. Debido a su lento metabolismo y excreción, el alto D-lactato puede causar acidosis y encefalopatía.


Amoníaco en suero
El amoníaco se deriva de la acción enzimática bacteriana sobre los aminoácidos ingeridos. Es absorbido desde el tracto gastrointestinal y transportado a través de la vena porta hasta el hígado, que convierte la mayoría de este en urea. Los niveles anormalmente altos de amoníaco pueden resultar de cólicos o “hiperamonemia entérica” (combinación de producción bacteriana aumentada y aumento de la permeabilidad intestinal) que ocurre a pesar de la función hepática normal. La hiperamonemia es una condición metabólica caracterizada por niveles elevados de amoníaco en la sangre. El aumento de la entrada de amoníaco al cerebro es la principal causa de trastornos neurológicos, trastornos metabólicos y algunas encefalopatías tóxicas.
Inflamación intestinal en autismo
Autismoygastrointestinal
Varios informes han revelado una alta prevalencia de síntomas gastrointestinales, (revisado por Horvath y Perman, Curr Gastroenterol Rep. 2002).
Se encontraron grados leves a moderados de inflamación en el tracto intestinal superior e inferior. En niños con ASD, la presencia de disfunción GI a menudo se asocia con mayor irritabilidad, berrinches, comportamiento agresivo y trastornos del sueño (revisado por Critchfield et al., Gastroenterol Res Pract. 2011).

Ensayos basados en heces para la inflamación intestinal.

Prueba ELISA sIgA en muestra de heces
La función clave de sIgA es unirse a microorganismos y toxinas invasores y atraparlos en la capa mucosa o dentro de las células epiteliales, inhibiendo así la motilidad microbiana, aglutinando los organismos y neutralizando sus exotoxinas y luego ayudando en su eliminación inofensiva del cuerpo a través de las heces. fluir.
La concentración de sIgA nos da información sobre la defensa inmune intestinal:
La falta de sIgA indica una actividad disminuida del sistema inmunológico intestinal.
Un nivel elevado de sIgA muestra inflamación intestinal.
Prueba ELISA de beta-Defensina-2 en muestras de heces
Las defensinas ejercen un grado variable de actividad antimicrobiana contra bacterias, hongos y algunos virus con envoltura. La expresión de ß-defensinas es inducida por las citocinas proinflamatorias y también por microorganismos (p. ej. E. coli, H. pylori o P. aeruginosa) y por microorganismos probióticos. Por ejemplo, se puede observar una deficiencia de ß-defensina-2 en la mucosa intestinal de pacientes con enfermedad de Crohn. Por lo tanto, el sistema de defensa de la mucosa queda limitado y permite una mayor invasión de bacterias, lo que podría provocar una infección típica en los pacientes con enfermedad de Crohn.
Resultados recientes implican que la ß-defensina-2 se sobreexpresa en la inflamación intestinal activa, especialmente en la colitis ulcerosa.
Prueba EDN/EPX ELISA en muestras de heces
La acumulación de EDN en el intestino está asociada con inflamación y daño tisular. La EDN fecal se considera la mejor de las proteínas granulares citotóxicas para la evaluación de la inflamación intestinal. Los niveles elevados de EDN fecal están relacionados con múltiples afecciones inflamatorias, como alergia/sensibilidad alimentaria, infecciones patógenas (C. difficile y H. Pylori), síndrome del intestino irritable y trastornos gastrointestinales eosinofílicos.
Marcadores de inflamación en muestras de heces.
Hemoglobina: descargada con las heces en enfermedades hemorrágicas gastrointestinales.
Transferrina: un componente derivado de la sangre; un buen marcador de hemorragia gastrointestinal
Calprotectina: una proteína citosólica de neutrófilos con propiedades antimicrobianas, que está presente en concentraciones elevadas en las heces durante la inflamación intestinal.
Lactoferrina: componente primario de la respuesta inflamatoria aguda liberada por los leucocitos fecales; puede servir como marcador de inflamación en el intestino.

La importancia de evaluar las disfunciones intestinales

MIJATOVIC T. ET AL., 2018, AIMS MOLECULAR SCIENCE 5:173-182.
Ensayos para infecciones intestinales

INFECCIONES: evaluación en muestras de heces
Pruebas basadas en Ag para Clostridium, Yersinia, Enterovirus, Parásitos, etc
INFECCIONES: evaluación viral y bacteriana basada en PCR en biopsias intestinales
Importancia de las pruebas de trastornos gastrointestinales
Los síntomas gastrointestinales pueden superponerse con los síntomas centrales del TEA a través de diferentes mecanismos.
Los factores patogénicos compartidos y los mecanismos fisiopatológicos que posiblemente vinculen el TEA y las alteraciones gastrointestinales, como lo demuestran los estudios más recientes, incluyen, entre otros
Inflamación intestinal con o sin autoinmunidad,
Permeabilidad intestinal,
Alergias a los alimentos,
Disbiosis
También se ha demostrado que la desregulación del microbioma intestinal está involucrada en la modulación de las funciones gastrointestinales con la capacidad de afectar la permeabilidad intestinal, la función inmune de las mucosas y la motilidad y sensibilidad intestinal.
La desregulación inmune, la inflamación gastrointestinal, el microbioma disbiótico y los metabolitos de la dieta pueden contribuir a la disfunción cerebral y la neuroinflamación. El empeoramiento inexplicable de las conductas no verbales (agitación, ansiedad, agresión, autolesiones, falta de sueño) debería alertar a los profesionales sobre esta posibilidad.

Resumen: pruebas de trastornos gastrointestinales

Ensayos útiles para investigar disfunciones intestinales:
Pruebas de sangre: sCD14, concentración de amoníaco, ensayo de deficiencia de lactasa, D-lactato
Pruebas BASADAS EN BIOPSIA: Detección basada en PCR de infecciones virales y bacterianas
Pruebas BASADAS EN HECES:
Marcadores de inflamación intestinal en muestras de heces: sIgA, Beta-2 Defensina, EPX/EDN, marcadores de inflamación en muestras de heces
! La inflamación intestinal contribuye a una mayor translocación bacteriana.
Infecciones intestinales: pruebas antigénicas por inmunocromatografía para infección intestinal.
Intestino permeable: prueba ZONULIN ELISA en muestras de heces
Disbiosis: ensayo MSA (prueba metagenómica en heces)
Prevotella alta: acidificación intestinal; Producción de H2S ➔ colapso mitocondrial,
Bifidobacterium bajo: Bifido no soporta el pH bajo
Alta Clostridium IV ➔ producción de metabolitos tóxicos
Enterococos – anaerobios facultativos, si hay inflamación ➔ crecimiento excesivo
Pruebas para infecciones / infecciones crónicas

Infecciones transmitidas por garrapatas y autismo
Numerosos médicos y padres han observado una asociación entre la enfermedad de Lyme (LYD) y otras infecciones transmitidas por garrapatas (TBI) durante el desarrollo fetal y en la infancia con el autismo, los trastornos del espectro autista (TEA) y los síntomas autistas.
El tratamiento de la TBI durante el embarazo puede prevenir el desarrollo de TEA asociado con la TBI (Bransfield et al., Med. Hypotheses 2008),
Bransfield et al. escribieron en 2008 un artículo de revisión (Med. Hypotheses 2008) para recopilar información de presentaciones en conferencias sobre este tema con otras fuentes que abordan más a fondo esta asociación. Indicaron que los datos preliminares sugieren que la borreliosis puede contribuir en un 20% a un 30% de los TEA, y el micoplasma patógeno puede contribuir en un 58%.
El trastorno del espectro autista es el resultado de múltiples etiologías con contribuciones tanto genéticas como ambientales, incluidas al menos 23 infecciones diferentes, siete de las cuales son infecciones crónicas (Babesia, Bartonella, B. burgdorferi, Ehrlichia, Herpesvirus humano-6, Chlamydia pneumoniae y Mycoplasma), y las reacciones inmunes asociadas con estas infecciones (Bransfield, Pediatr Health 2009).


Pruebas de detección de la enfermedad de Lyme
Importancia de ampliar los objetivos de las pruebas relacionadas con la borreliosis (es decir, no solo pruebas para B. burgdorferi sl)
La expansión generalizada de casos de enfermedad de Lyme no diagnosticados en todo el mundo podría estar relacionada con la elección de solo hacer pruebas de detección para B. Burgdorferi sl y rara vez para B. miyamotoi, siendo esta última aparentemente mucho más prevalente. Buscar la presencia bacteriana real utilizando pruebas basadas en fagos podría apaciguar el debate y las controversias sobre las elecciones de pruebas y los pacientes en etapas tardías o crónicas.
Importancia de los nuevos enfoques de prueba
El elevado índice de fracaso general de las pruebas relacionadas con infecciones transmitidas por garrapatas (TBI) subraya la necesidad de nuevos enfoques, es decir, no depender de la serología y las pruebas de dos niveles.
Enfoques novedosos de pruebas: prueba basada en fagos
La importancia de los enfoques de prueba novedosos
El método de detección de Phelix Phage Borrelia (Patente WO2018083491A1) consiste en dirigirse a la presencia de profagos superados como parte del ciclo lisogénico de bacterias. Los bacteriófagos solo están presentes en las infecciones bacterianas activas; por lo tanto, una prueba basada en fagos es una prueba directa de una infección activa.
El ciclo lisogénico: El fago infecta una bacteria e inserta su ADN en el cromosoma bacteriano, permitiendo que el ADN del fago (ahora llamado un profago) se copie y se transmita junto con el propio ADN de la célula.
El ciclo lítico: El fago infecta a una bacteria, se apodera de la bacteria para producir muchos fagos y luego mata a la célula haciéndola explotar (lisis).


Prueba de fago Phelix para borrelia
Los bacteriófagos podrían convertirse en una herramienta de diagnóstico basada en el principio de que si hay fagos es porque hay bacterias vivas.
Phelix Charity junto con el departamento de microbiología de la Universidad de Leicester han desarrollado recientemente una prueba de PCR basada en fagos de Borrelia buscando 3 grupos principales de
Borrelia:
Borrelia burgdorferi sl (incluyendo B. burgdorferi ss, B. afzelii, B. garinii, B. spielmanii, etc)
Borrelia miyamotoi y
Grupo de fiebre recurrente (B. recurrentis, B. hermsii, etc).
Este método se utiliza eficientemente para evaluar tanto muestras humanas como garrapatas.
Altamente sensible y específico.
No genera señal positiva contra otras cepas bacterianas.
Los falsos positivos se descartan mediante secuenciación.

Disfunción inmune en TBD
Una característica distintiva de la enfermedad de Lyme crónica es una disfunción inmune subyacente que no solo limita la capacidad de diagnosticar Lyme con precisión, dejando a muchos de estos pacientes con un diagnóstico erróneo, sino que también sirve como una de las principales razones de la falta de respuesta al tratamiento con antibióticos, con la incapacidad de erradicar la infección crónica. .
La bacteria Borrelia (causa de la enfermedad de Lyme) se transforma de una infección aguda a una crónica al transformar el cuerpo en una respuesta dominante “extracelular” TH2 y luego pasar de una forma de espiroqueta que nada libremente en la sangre a una forma intracelular (forma L). para escapar de la elevada inmunidad TH2. La respuesta inmune intracelular TH1 suprimida y regulada a la baja se convierte en una respuesta inmune ineficaz del cuerpo y en una estrategia de evasión efectiva, que es el sello distintivo de la transformación hacia la diseminación de Lyme en etapa tardía.
Las terapias inmunomoduladoras apropiadas que sean capaces de restaurar el funcionamiento normal de la inmunidad pueden ser el mayor avance necesario en el desarrollo de un protocolo de tratamiento eficaz para esta enfermedad multisistémica.


Mycoplasma ssp., coinfecciones humanas por hv6, patógenos intracelulares en TEA
Nicolson y cols. (J Neurosci Res. 2007) examinaron la sangre de 48 pacientes del centro y sur de California diagnosticados con trastornos del espectro autista (TEA) y encontraron que un gran subconjunto de pacientes con TEA muestra evidencia de infecciones bacterianas y/o virales.
un gran subconjunto (28/48 o 58,3%) de pacientes mostró evidencia de Mycoplasma spp. infecciones en comparación con dos de 45 (4,7%) sujetos de control de la misma edad.
la prevalencia de coinfecciones por el virus del herpes humano-6 (HHV-6, 14/48 o 29,2%) en pacientes con TEA versus 4/48 o 8,3% en sujetos de control.
Como informó Blinstock (Med. Hypotheses 2001), varios subgrupos del espectro del autismo derivan de patógenos intramonocitos como el virus del sarampión, el citomegalovirus, el herpesvirus humano 6 y Yersinia enterocolitica. En algunos de estos niños, uno o más de estos patógenos persiste como una infección crónica activa, aparentemente subclínica, etiológicamente significativa para los rasgos autistas del niño. Dentro de estos subgrupos, las deficiencias inmunitarias y las infecciones atípicas pueden ser tratables.
Un círculo vicioso

Conclusiones
Cada vez más evidencias apuntan hacia una combinación de factores (genéticos, infecciosos, ambientales, etc.) siendo importantes en el desarrollo de disfunciones inmunes crónicas, el hallazgo cardinal en pacientes autistas.
En muchos países, los TEA aún se consideran psiquiátricos a pesar de las claras evidencias biomédicas.
Para un mejor manejo de esta aflicción que sufre de falta de reconocimiento médico, necesitamos considerar PRUEBAS DE ESPECIALIDAD
Basándonos en las publicaciones recientes y las extensas colaboraciones con médicos especializados en el manejo de trastornos relacionados con el autismo, desarrollamos una oferta de pruebas dedicada centrada en:
disfunciones inmunes globales
infecciones persistentes y/o crónicas, especialmente la infección transmitida por garrapatas
disfunciones intestinales e inflamación intestinal
Se necesita una red más amplia de nuevas colaboraciones para un mayor avance en el descifrado y validación de biomarcadores de autismo


Enfoque integrador para el análisis de pacientes con infecciones tardías / persistentes / crónicas transmitidas por garrapatas (TBI)
Las infecciones transmitidas por vectores están aumentando a nivel mundial.
Las más conocidas, y la principal preocupación de investigación incluyen borreliosis, bartonelosis, babesiosis, rickettsiosis y anaplasmosis. Muchos otros patógenos pueden empeorar el cuadro clínico y complicar aún más el diagnóstico diferencial.
Lea nuestro resumen actualizado, disponible en diferentes idiomas ( www.redlabs.com)
Infecciones transmitidas por garrapatas
Las enfermedades transmitidas por garrapatas, que afectan a los seres humanos y a otros animales, son causadas por agentes infecciosos transmitidos por las picaduras de garrapatas.➔Siempre que sea posible, hágase la prueba de PCR de la garrapata
Las enfermedades transmitidas por garrapatas son causadas por una infección con una variedad de patógenos.
Las infecciones transmitidas por garrapatas están aumentando a nivel mundial: la enfermedad de Lyme se encuentra entre las infecciones transmitidas por vectores más prevalentes en los EE. UU. y Europa y está alcanzando niveles epidémicos (Kugeler et al. 2015; Sykes et al. 2014).
Descarga nuestro FOLLETO DE CONCIENCIA SOBRE LAS GARRAFAS disponible en diferentes idiomas
(ver www.redlabs.com)

Folleto de concienciación sobre las garrapatas (1)

Folleto de concienciación sobre garrapatas (2)

Folleto de concienciación sobre las garrapatas (3)

Folleto de conciencia sobre garrapatas (4)


Infecciones transmitidas por garrapatas
La enfermedad de Lyme es la enfermedad transmitida por garrapatas más conocida y está causada por bacterias del género Borrelia.
Debido a que las garrapatas individuales pueden albergar más de un agente causante de enfermedades, los pacientes pueden infectarse con más de un patógeno al mismo tiempo, lo que agrava la dificultad de diagnóstico y tratamiento.
Entre las infecciones desatendidas, hay pocas que merecen más atención e investigación, como la tularemia, la yersinia, el micoplasma, la clamidia, el virus de Epstein-Barr y los herpesvirus. Nuestros datos muestran que la prevalencia de estas infecciones no es insignificante y deberían investigarse más.
Recordar
Es importante tener en cuenta que el TBD puede ser agudo o tardío/persistente/crónico; Esto es importante dado que los enfoques de diagnóstico y tratamiento pueden ser diferentes en estas dos situaciones.
La enfermedad de Lyme presenta una variedad de síntomas que pueden confundirse con trastornos inmunológicos e inflamatorios.
Si una persona tiene alguna condición de salud crónica, desde artritis hasta síndrome de fatiga crónica y fibromialgia, es importante descartar o diagnosticar enfermedades transmitidas por garrapatas. Es evidente que muchos casos de fibromialgia y síndrome de fatiga crónica son en realidad TBD disfrazados.
Los pacientes crónicos tienen un cuadro clínico complejo con múltiples afecciones que necesitan, por lo tanto, múltiples pruebas y una interpretación cuidadosa de los resultados de las pruebas.
Enfermedad de Lyme crónica
La enfermedad de Lyme crónica puede imitar todos los procesos patológicos, incluido el síndrome de fatiga crónica (encefalomielitis miálgica), fibromialgia, afecciones autoinmunes que incluyen artritis reumatoide seronegativa y esclerosis múltiple, afecciones psiquiátricas que incluyen depresión y ansiedad, y causar importantes problemas de memoria y concentración que imitan la demencia temprana. Se le llama el "Gran Imitador"
Si una persona tiene alguna condición de salud crónica, desde artritis hasta síndrome de fatiga crónica y fibromialgia, es importante descartar o diagnosticar la enfermedad de Lyme. Es evidente que muchos casos de fibromialgia y síndrome de fatiga crónica son en realidad la enfermedad de Lyme disfrazada.
Los enfermos crónicos de Lyme también padecen con frecuencia “coinfecciones” como Mycoplasma, Chlamydias, Ehrlichia, Bartonella y Babesia. Estos son diferentes tipos de “bichitos” que disfrutan de la compañía de B. burgdorferi

Recordar
La alta tasa general de fracaso de las terapias para las infecciones transmitidas por vectores, especialmente en pacientes tardíos/persistentes/crónicos, subraya la necesidad de investigar a fondo diferentes infecciones concurrentes junto con las desregulaciones gastrointestinales e inmunes resultantes.
Es importante investigar diferentes “coinfecciones” (es decir, infecciones transmitidas por garrapatas), pero también otras infecciones oportunistas (virales, bacterianas, parasitarias).

Pruebas para infecciones transmitidas por garrapatas
Diagnosticar la enfermedad de Lyme y las enfermedades relacionadas con TBI es extremadamente desafiante.
Las complicaciones en el diagnóstico de TBI son resultado de pruebas inadecuadas, enfocándose principalmente en marcadores para las primeras etapas de la enfermedad.
Los casos de Lyme son comúnmente mal diagnosticados con otras enfermedades e incluso cuando se hace un diagnóstico correcto, a menudo es difícil de verificar porque las pruebas precisas no siempre están disponibles.
Muy pocas pruebas para enfermedades transmitidas por garrapatas (TBD) están aprobadas para el diagnóstico clínico, por lo tanto, la mayoría de las opciones de prueba disponibles son pruebas "investigativas" o de "investigación", con el objetivo de ayudar en la evaluación de pacientes con quejas similares a las de Lyme.
Enfoque integrador para pruebas tbd: parte 1 - detección de patógenos


Pruebas actualmente utilizadas para la detección de borrelia y sus limitaciones

Necesidad de desarrollo de nuevas pruebas

Cooperación entre la academia, el laboratorio de pruebas y los especialistas médicos



Enfoques novedosos de prueba: prueba basada en fagos
La importancia de los enfoques novedosos de prueba
La alta tasa de fallos en general de las pruebas relacionadas con la infección transmitida por garrapatas (TBI) subraya la necesidad de enfoques novedosos, es decir, no depender de la serología y las pruebas de dos niveles. El método de detección de Borrelia Phelix Phage (Patente WO2018083491A1) consiste en dirigirse a la presencia de profagos superados en número como parte del ciclo lisogénico de las bacterias.
Los bacteriófagos están presentes solo en infecciones bacterianas activas; por lo tanto, una prueba basada en fagos es una prueba directa de una infección activa.
El ciclo lisogénico: El fago infecta una bacteria e inserta su ADN en el cromosoma bacteriano, permitiendo que el ADN del fago (ahora llamado profago) sea copiado y pasado junto con el propio ADN de la célula.
El ciclo lítico: El fago infecta una bacteria, secuestra la bacteria para hacer muchos fagos, y luego mata la célula haciéndola explotar (liar).


Prueba del fago borrelia Phelix
Los bacteriófagos podrían convertirse en una herramienta de diagnóstico basada en el principio de que si hay fagos es porque hay bacterias vivas.
Phelix Charity junto con el departamento de microbiología de la Universidad de Leicester han desarrollado recientemente una prueba de PCR basada en fagos de Borrelia que busca 3 grupos principales de Borrelia:
Borrelia burgdorferi sl (incluidas B. burgdorferi ss, B. afzelii, B. garinii, B. spielmanii, etc.)
Borrelia miyamotoi y
Grupo de fiebre recurrente (B. recurrentis, B. hermsii, etc).
Este método se utiliza eficazmente para evaluar tanto muestras humanas como de garrapatas. Altamente sensible y específico.
No genere señal positiva contra otras cepas bacterianas.
Las falsas positivas se descartan por secuenciación/ Los falsos positivos se descartan por secuenciación.

Recordatorio sobre métodos de diagnóstico disponibles

Enfermedad de Lyme crónica y coinfecciones.
Enfermedad de Lyme crónica y coinfecciones.
En la enfermedad de Lyme se producen con frecuencia infecciones concurrentes. Los agentes coinfectantes pueden transmitirse junto con Borrelia burgdorferi por picadura de garrapata, lo que produce múltiples infecciones, pero una fracción de las coinfecciones se produce independientemente de la picadura de garrapata.
Las coinfecciones clínicamente relevantes son causadas por especies de Bartonella, Yersinia enterocolitica, Chlamydophila pneumoniae, Chlamydia trachomatis y Mycoplasma pneumoniae.
Las infecciones causadas por estos patógenos en pacientes no infectados por Borrelia burgdorferi pueden provocar síntomas clínicos similares a los que ocurren en la enfermedad de Lyme. Esto se aplica particularmente a las infecciones causadas por Bartonella henselae, Yersinia enterocolitica y Mycoplasma pneumoniae. Chlamydia trachomatis causa principalmente poliartritis. Chlamydophila pneumoniae no sólo provoca artritis sino que también afecta al sistema nervioso y al corazón, lo que dificulta el diagnóstico diferencial. El diagnóstico es aún más complejo cuando las coinfecciones ocurren asociadas con la enfermedad de Lyme. (de Berghoff W. Open Neurol J. 2012;6:158-78.)
La enfermedad de Lyme presenta una variedad de síntomas que pueden confundirse con trastornos inmunológicos e inflamatorios.

Enfoque integrador para pruebas por determinar: parte 1 – detección de patógenos

Prueba del fago borrelia Phelix
Immunoblot for Borrelias, Chlamydias (pneumoniae, trachomatis, psittacii), Yersinia, EBV, Parvovirus, Treponema, Tropical fever (Chikungunya virus + Dengue fever virus + Zika virus), Hepatitis E Virus, etc
Pruebas serológicas para CMV, Toxoplasmosis, Tularemia, Leptospira, BrucellaCapt
Prueba FISH para Babesia
PCRs para Mycoplasma spp, Mycoplasma fermentans, Mycoplasma pneumoniae, Bartonella, Brucella, Coxiella, Babesia, Anaplasma, Ehrlichia, Chlamydias, Rickettsias, Midichloria mitochondrii, etc.
PCR para infecciones virales: herpesvirus como HHV-6, HHV-7, HHV-8, parvovirus, EBV, citomegalovirus, virus de la encefalitis transmitida por garrapatas, virus del Nilo Occidental, virus Coxsacki, enterovirus
MOHOS Serología: IgG contra 6 mohos principales: Candida albicans, Cladosporium herbarum, Aspergillus niger, Alternaria alterna, Penicillium chrysogenum, Aspergillus fumigatus
Cuantificación de micotoxinas en orina.
Pruebas de parásitos
Nuevas pruebas en desarrollo

Yersinia
Las bacterias del género Yersinia son enterobacterias Gram negativas. De las 17 especies descritas, se sabe que 3 son patógenos humanos:
Yersinia pestis causa la peste bubónica y neumónica. La peste bubónica se transmite por la picadura de pulgas de rata infectadas. Se desarrollan ganglios linfáticos (bubones) inflamados y ennegrecidos, seguidos de septicemia y neumonía hemorrágica y muerte. La forma neumónica se transmite directamente de persona a persona a través de gotitas respiratorias. Los brotes son de naturaleza explosiva e invariablemente letales.
Yersinia enterocolitica causa diarrea severa y abscesos locales.
Yersinia pseudotuberculosis causa enterocolitis grave.
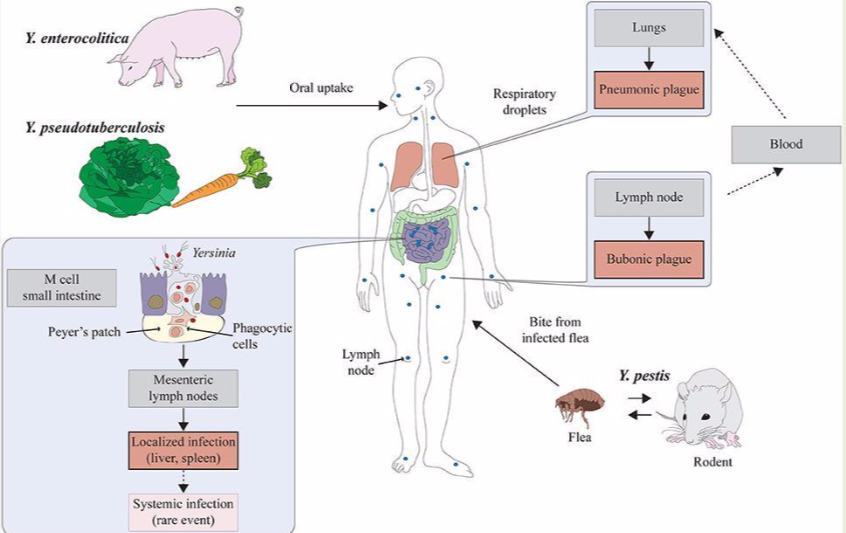
La fuente más común de infección por Y. enterocolitica en humanos es la carne de cerdo (cruda o poco cocida) y también el agua, la carne o la leche contaminadas.
Otras cepas de Yersinia también se encuentran en muchos otros animales, incluidos roedores, conejos, ovejas, vacas, caballos, perros y gatos.
Yersinia pseudotuberculosis es una bacteria Gram negativa que causa la escarlatina del Lejano Oriente en humanos.
Las infecciones por Y. pseudotuberculosis pueden simular una apendicitis; la enfermedad puede causar molestias en la piel (eritema nudoso), rigidez y dolor en las articulaciones (artritis reactiva) o propagación de bacterias a la sangre (bacteriemia). La pseudotuberculosis Y causa abscesos intestinales severos
Genéticamente, el patógeno que causa la peste, Y. pestis, es muy similar a Y. pseudotuberculosis. La peste parece haber evolucionado a partir de Y. pseudotuberculosis.
Los síntomas comunes son:
Fiebre
dolor abdominal y
diarrea (que a menudo es con sangre)
Las complicaciones incluyen:
Dolor en las articulaciones
erupciones (eritema nudoso)
Algunas personas presentan síntomas leves, por lo que son difíciles de descubrir.
Las infecciones por Yersinia a veces van seguidas de enfermedades inflamatorias crónicas como artritis, eritema nudoso y artritis reactiva.
Yersinia puede estar asociada con la enfermedad de Crohn
Los mitógenos derivados de Yersinia pseudotuberculosis (YpM) son superantígenos que pueden activar excesivamente las células T al unirse al receptor de células T. Dado que YpM puede activar una gran cantidad de población de células T, esto provoca la liberación de citoquinas inflamatorias.

La importancia de las pruebas para yersinia

Estos desafíos inflamatorios repetidos y no regulados pueden remodelar profundamente el sistema inmunológico y contribuir así a la carga creciente de trastornos autoinmunes e inflamatorios.
En conjunto, este estudio proporciona un marco para entender cómo las infecciones previamente encontradas pueden provocar un colapso de la homeostasis inmunológica del tejido, contribuyendo así a la enfermedad más tarde en la vida. Por lo tanto, para comprender completamente la etiología de las enfermedades complejas, puede ser necesario mirar más allá de las susceptibilidades genéticas de un paciente y los factores estresantes ambientales concurrentes y examinar si las cicatrices inmunológicas asociadas con infecciones previas pueden haber 'preparado el terreno' para la inflamación crónica.
Estos desafíos inflamatorios repetidos y no regulados pueden remodelar profundamente el sistema inmunológico y contribuir así a la carga creciente de trastornos autoinmunes e inflamatorios.

Yersinia – resultados de las pruebas
Las pruebas de inmunotransferencia de Yersinia permiten detectar infecciones pasadas por Yersinia y, por lo tanto, son ideales para la identificación de complicaciones inmunopatológicas inducidas por Yersinia y yersiniosis crónica. La detección de anticuerpos IgG e IgA puede ser una herramienta de diagnóstico muy útil si se sospecha artritis inducida por Yersinia.
An immunoblot for the detection of IgG and IgA antibodies against all pathogenic Yersinia by means of Yersinia outer proteins (YOPs). Serological differentiation of Y. enterocolitica and Y. pseudotuberculosis infections is possible for the first time with the use of new species-specific Yersinia antigens (PsaA, MyfA).
Período de prueba: 1 de mayo de 2015 – 1 de mayo de 2019 (4 años)
Inmunotransferencia en suero
Total analizado: 2396 muestras
IgA positivos: 412 (➔17,2%)
IgG positiva: 946 (➔39.5%) Total probado: 2396 muestras/IgG positivo: 946 (➔39.5%) Total probado: 2396 muestras
IgG, sin diferenciación: 624 positivos (➔66% de los positivos de IgG; 26,1% de todos los analizados
IgG Y. pseudotuberculosis: 202 positivos (➔21,4% de los positivos de IgG; 28,4% de todos los analizados
IgG Y. enterocolitica: 120 positivos (➔12,6% de los positivos de IgG; 5% de los a2l8l analizados
Tularemia
La tularemia, también conocida como fiebre de los conejos, es una enfermedad infecciosa causada por la bacteria Francisella tularensis.
Las personas pueden infectarse de varias maneras, entre ellas:
Picaduras de garrapatas y moscas de los venados
Contacto de la piel con animales infectados.
Beber agua contaminada
Inhalación de aerosoles contaminados o polvo agrícola y de jardinería: puede ocurrir durante actividades agrícolas o de jardinería, especialmente cuando maquinaria (por ejemplo, tractores o cortadoras de césped) pasa sobre animales o cadáveres infectados.
Exposición de laboratorio
Las personas podrían quedar expuestas como resultado del bioterrorismo.

No se sabe que la tularemia se transmita de persona a persona. No es necesario aislar a las personas que tienen tularemia.
No se sabe que la tularemia se transmita de persona a persona. No es necesario aislar a las personas que tienen tularemia.
Algunas personas presentan síntomas leves, por lo que son difíciles de descubrir.
Los síntomas varían según cómo se infectó la persona:
Ulceroglandular: ocurre después de la picadura de una garrapata o de una mosca de los ciervos o después de la manipulación de un animal infectado. Aparece una úlcera en la piel en el lugar por donde la bacteria ingresó al cuerpo. La úlcera se acompaña de inflamación de los ganglios linfáticos regionales.
Glandular: similar a la tularemia ulceroglandular pero sin úlcera. También se adquiere generalmente a través de la picadura de una garrapata infectada o de una mosca de los ciervos o por el manejo de animales enfermos o muertos.
Oculoglandular: ocurre cuando las bacterias ingresan por el ojo. Esto puede ocurrir cuando una persona está sacrificando un animal infectado y se toca los ojos. Los síntomas incluyen irritación e inflamación del ojo e hinchazón de los ganglios linfáticos delante del oído.
Orofaríngea: resulta de comer o beber agua o alimentos contaminados. Los pacientes con tularemia orofángica pueden tener dolor de garganta, úlceras en la boca, amigdalitis e inflamación de los ganglios linfáticos del cuello.
Neumónica: la forma más grave de tularemia. Los síntomas incluyen tos, dolor en el pecho y dificultad para respirar. Esta forma resulta de respirar polvos o aerosoles que contienen el organismo. También puede ocurrir cuando otras formas de tularemia (por ejemplo, ulceroglandular) no se tratan y las bacterias se propagan a través del torrente sanguíneo hasta los pulmones.
Tifoidea: caracterizada por cualquier combinación de síntomas generales (sin los síntomas localizados de otros síndromes)

Tularemia: resultados de las pruebas
Periodo de prueba: 1 de julio de 2015 - 1 de mayo de 2019
Prueba de detección: inmunocromatografía en suero
Total probado: 1769 muestras
392 (= 22.16%) se encontraron positivos y se sometieron a pruebas de confirmación Total probado: 1769 muestras
Prueba de confirmación: IVD Tularemia IgM ELISA
392 fueron a la prueba de confirmación
87 se encontraron en el límite (22,2% entre los que fueron a la prueba de confirmación, 5% del total de muestras probadas)
117 se encontraron positivos (29,8% entre los que fueron a la prueba de confirmación, 6,6% del total de muestras probadas)
Herpes viruses – HHV6 & HHV7
El HHV-6 tiene una prevalencia muy alta (cerca del 100% de la población mundial ha estado expuesta); La infección primaria a menudo se asocia con una afección febril y, a veces, con la aparición de roséola (exantema súbitum).
HHV-6 tiene efectos inmunomoduladores, incluida la supresión de la proliferación de células T y la alteración de la producción de citoquinas.
Esta inmunosupresión puede favorecer el desarrollo o progresión de otras infecciones virales como CMV, EBV o VIH.
Prueba qPCR HHV6: el 3% de las muestras de sangre analizadas (509 muestras) resultaron positivas con alta carga viral, y el 13% de ellas presentan integración cromosómica HVV6.

El HHV-7 está estrechamente relacionado con el HHV-6; la infección primaria suele ocurrir más tarde en la infancia que la infección por HHV-6; también puede causar exantema súbitum.
HHV-7 infecta y se replica eficazmente en células CD4+; se puede encontrar en el tejido cerebral pero con una frecuencia más baja que el HHV-6.
Se ha sugerido que el HHV-7 podría reactivar el HHV-6 desde la latencia. Se ha informado de una mayor prevalencia en personas con enfermedades autoinmunes. Algunas personas presentan síntomas leves, por lo que son difíciles de descubrir.
Prueba qPCR HHV7: el 34,4% de las muestras de sangre analizadas (128 muestras) resultaron positivas con carga viral alta.
Dado que la mayoría de la población ha estado expuesta al HHV, se prefieren las pruebas qPCR a las pruebas serológicas.

Virus ebv-epstein-barr
El VEB (VHH-4) infecta a más del 90% de la población adulta del mundo.
Se transmite por contacto salival; El virus se replica primero en el epitelio de la orofaringe antes de infectar los linfocitos B, donde persistirá de por vida en estado latente.
Se sabe que la reactivación del EBV ocurre en momentos de estado inmunocomprometido, estrés celular e inflamación.
Después de la infección inicial, el VEB puede reactivarse y se ha demostrado que tiene muchas conexiones con diversas enfermedades crónicas.
Se sabe que la infección por el virus de Epstein-Barr causa resultados falsos positivos en las pruebas serológicas de la enfermedad de Lyme, particularmente en las pruebas de IgM.
Prueba de inmunotransferencia del VEB (393 muestras analizadas):
Muestras positivas IgM: 3%
Muestras positivas de IgG: 85%, 2% con infección reciente
IgG positiva: 946 (➔39.5%) Total probado: 2396 muestras/IgG positivo: 946 (➔39.5%) Total probado: 2396 muestras
Las pruebas qPCR deben agregarse a las pruebas serológicas.
Mycoplasma
Se encontró que las garrapatas portan M. Pneumonae, M. Genitalium y M. Fermentans
Estas infecciones están exacerbando a los pacientes con CTBI, especialmente aquelos con manifestaciones autoinmunes.
Mycoplasma spp causa que las células B sean sobreestimuladas, promoviendo la enfermedad autoinmune y reumatoide
Mycoplasma aumenta la producción de IL-1beta y IL-6
Malos resultados de tratamiento con antibióticos
La prueba PCR en fluidos corporales y biopsias se prefiere a la prueba serológica
Prueba de PCR de esputo y swaps (total 111 muestras) con secuenciación confirmatoria: 28.8% positivos


Clamidia
Las garrapatas NO portan clamidia PERO se reactivan en presencia de T.B.I.
C. Pneumonae
C. Trachomatis
C. Psittaci
HP60 se expresa ➔ artritis, impulsa reacciones autoinmunes, crea radicales libres y estrés oxidativo
Clamidia ➔ activa NF kappa B ➔ moléculas inflamatorias/citoquinas
Un inmunoblot para la detección de anticuerpos IgG e IgA contra Chlamydia trachomatis, Chlamydophila pneumoniae y Chlamydophila psittacci:
1927 muestras probadas:
IgA Chlamydophila pneumoniae: 9.8% positivos
IgA Chlamydophila psittacci: 0.4% positivos
IgA Chlamydila ptrachomatis: 6.7% positivos
Enfoque integrador para tbi parte 2 – disfunciones intestinales

Disfunciones intestinales
Regulación de la función inmune en el intestino.
El 80% de nuestras células inmunes residen en el intestino.
El tejido linfoide asociado al intestino (GALT) se disemina a lo largo de la mucosa intestinal (placa de Peyer en el intestino delgado, folículos linfoides en el colon) y alberga el 80% de las células inmunitarias del cuerpo.
Estas células inmunitarias interactúan permanentemente con los microorganismos asociados a las mucosas (bacterias, virus…)
Se mantiene un delicado equilibrio entre la tolerancia a los antígenos intestinales (regulación negativa de la inflamación,…) y la defensa contra patógenos (producción de defensinas,…)
El desequilibrio de la inmunidad intestinal afecta a todo el cuerpo.
La integridad de la barrera intestinal es esencial: el aumento de la permeabilidad de la mucosa provoca endotoxemia sistémica (inflamación crónica de bajo grado) y reacciones inmunes anormales a los antígenos intestinales.
Interacciones huésped/flora intestinal: la flora microbiana intestinal desempeña un papel importante en el mantenimiento de la salud del huésped, pero puede verse afectada por una función inmune anormal del huésped.

Tbi y trastornos gastrointestinales
Los signos y síntomas relacionados con el tracto gastrointestinal y el hígado pueden proporcionar pistas importantes para el diagnóstico de diversas enfermedades transmitidas por garrapatas

DE: MANIFESTACIONES GASTROINTESTINALES Y HEPÁTICAS DE LAS ENFERMEDADES TRANSMITIDAS POR GARRAPATAS EN LOS ESTADOS UNIDOS SYED ALI ZAIDI & CAROL SINGER, CLIN INFECT DIS. 2002;34(9):1206-1212. DOI:10.1086/339871

Enfermedad de Lyme y trastornos gastrointestinales.
Los pacientes con Lyme y TBD pueden presentar principalmente manifestaciones gastrointestinales.
Conferencia ILADS de 2015, Dr. Farshid Rahbar: Estos pacientes pueden tener síntomas gastrointestinales complejos o persistentes que afectan el tracto gastrointestinal superior, medio o inferior y ya han sido tratados por problemas gastrointestinales.
Hinchazón/Gas: en el 76% de los pacientes Dolor abdominal: en el 48% de los pacientes
Estreñimiento: en el 42% de los pacientes.
Intolerancia alimentaria: en el 42% de los pacientes.
Movimientos intestinales irregulares: en el 37% de los pacientes.
El número de pacientes que presentan estos síntomas probablemente esté alcanzando proporciones epidémicas.
Es necesario incluir pruebas para detectar problemas gastrointestinales.
Ensayos útiles para investigar disfunciones intestinales:
Pruebas de sangre: sCD14, ensayo de deficiencia de lactasa, D-lactato, amoníaco en suero
Pruebas BASADAS EN BIOPSIA: Detección basada en PCR de infecciones virales y bacterianas
Pruebas BASADAS EN HECES:
Inflamación intestinal: sIgA, Beta-2 Defensina, EPX/EDN, Marcadores de inflamación en muestras de heces
Infecciones intestinales: pruebas antigénicas por inmunocromatografía para infecciones intestinales.
Intestino permeable: prueba ZONULIN ELISA en muestras de heces
Disbiosis: ensayo MSA (prueba metagenómica en heces)

Ensayos basados en sangre para disfunciones intestinales.

sCD14 en suero
sCD14 se expresa en monocitos/macrófagos y desempeña un papel fundamental en el reconocimiento de los componentes de la pared celular bacteriana (LPS). La parte extracelular de CD14 puede escindirse y liberarse en el plasma, donde inactivará el LPS circulante. Los niveles de CD14 soluble en suero están significativamente elevados en pacientes con intestino permeable, enfermedad inflamatoria intestinal, enfermedad de Crohn, pero también en pacientes que padecen brucelosis o enfermedad de Lyme.
Ensayo de deficiencia de lactasa
un polimorfismo en el gen que codifica la lactasa, una enzima responsable de la digestión de la lactosa (polimorfismo C/T-13910). En las personas afectadas, la producción de la enzima disminuye durante o poco después de la infancia, lo que provoca malabsorción de lactosa. Los azúcares de lactosa no digeridos afectan el desarrollo de la microflora intestinal y provocan disbiosis.
D-lactato en el suero
es un producto del metabolismo bacteriano, no es producido ni metabolizado por células de mamíferos. Normalmente, los niveles elevados de D-lactato se deben a una infección bacteriana o al síndrome del intestino corto en humanos. Debido al metabolismo y la excreción lentos, los niveles altos de D-lactato pueden causar acidosis y encefalopatía.
Amoníaco en suero
El amoníaco se deriva de la acción enzimática bacteriana sobre los aminoácidos ingeridos. Se absorbe en el tracto gastrointestinal y se entrega a través de la vena porta al hígado, donde la mayor parte se convierte en urea. Los niveles anormalmente altos de amoníaco pueden resultar de cólicos o “hiperamonemia entérica” (combinación de aumento de la producción bacteriana y aumento de la permeabilidad intestinal) que ocurren a pesar de la función hepática normal. La hiperamonemia es una condición metabólica caracterizada por niveles elevados de amoníaco en la sangre. El aumento de la entrada de amoníaco al cerebro es la causa principal de trastornos neurológicos, trastornos metabólicos y algunas encefalopatías tóxicas.


Consecuencias del intestino permeable: activación crónica (inflamación) del sistema inmunológico
Prueba de intestino permeable (Zonulina en heces): período de prueba de 3 años, 1301 muestras 63.87% pacientes con niveles aumentados!!
Lipopolisacárido (LPS): compuesto bacteriano que puede llegar fácilmente a la sangre.
Presente en el torrente sanguíneo, el LPS inducirá una fuerte respuesta proinflamatoria en los monocitos y macrófagos, que implica el reconocimiento por un receptor (receptor tipo Toll-4) y la posterior secreción de citoquinas como IL-1, IL-6, TNF-alfa.
El LPS también induce la producción de óxido nítrico mediada por NK-kB. Debido a que el NO aumenta, la función NK se inhibe y a menudo se observan infecciones oportunistas como las infecciones por micoplasma.
Los herpesvirus, que tienden a reactivarse en un contexto de activación inmunológica, también se detectarán con frecuencia.
Consecuencias del intestino permeable

Ensayos basados en heces para la inflamación intestinal.

Prueba ELISA sIgA en muestras de heces
La función clave de sIgA es unirse a microorganismos y toxinas invasores y atraparlos en la capa mucosa o dentro de las células epiteliales, inhibiendo así la motilidad microbiana, aglutinando los organismos y neutralizando sus exotoxinas y luego ayudando en su eliminación inofensiva del cuerpo a través de las heces. fluir.
La concentración de sIgA nos da información sobre la defensa inmune intestinal:
La falta de sIgA indica una actividad disminuida del sistema inmunológico intestinal.
Un nivel elevado de sIgA muestra inflamación intestinal.
Prueba ELISA Beta-Defensina-2 en muestras de heces
Las defensinas ejercen un grado variable de actividad antimicrobiana contra bacterias, hongos y algunos virus con envoltura. La expresión de ß-defensinas es inducida por las citocinas proinflamatorias y también por microorganismos (p. ej. E. coli, H. pylori o P. aeruginosa) y por microorganismos probióticos. Por ejemplo, se puede observar una deficiencia de ß-defensina-2 en la mucosa intestinal de pacientes con enfermedad de Crohn. Por lo tanto, el sistema de defensa de la mucosa se ve limitado y permite una mayor invasión de bacterias, lo que podría provocar una infección típica en los pacientes con enfermedad de Crohn.
Resultados recientes implican que la ß-defensina-2 se sobreexpresa en la inflamación intestinal activa, especialmente en la colitis ulcerosa.
Prueba EDN/EPX ELISA en muestras de heces
La acumulación de EDN en el intestino está asociada con inflamación y daño tisular. La EDN fecal se considera la mejor de las proteínas granulares citotóxicas para la evaluación de la inflamación intestinal. Los niveles elevados de EDN fecal están relacionados con múltiples afecciones inflamatorias, como alergia/sensibilidad alimentaria, infecciones patógenas (C. difficile y H. Pylori), síndrome del intestino irritable y trastornos gastrointestinales eosinofílicos.


Marcadores de inflamación en muestras de heces.
Hemoglobina: descargada con las heces en enfermedades hemorrágicas gastrointestinales.
Transferrina: un componente derivado de la sangre; un buen marcador de hemorragia gastrointestinal
Calprotectina: una proteína citosólica de neutrófilos con propiedades antimicrobianas, que está presente en concentraciones elevadas en las heces durante la inflamación intestinal.
Lactoferrina: componente primario de la respuesta inflamatoria aguda liberada por los leucocitos fecales; puede servir como marcador de inflamación en el intestino.
Ensayos para infecciones intestinales

FRÉMONT ET AL., IN VIVO 2009
INFECCIONES: evaluación en muestras de heces
Pruebas basadas en Ag para Clostridium, Yersinia, Enterovirus, Parásitos, etc
INFECCIONES: evaluación viral y bacteriana basada en PCR en biopsias intestinales
Ensayos basados en heces para disfunciones intestinales.

Prueba ZONULIN ELISA en muestras de heces
Zonulin es la “puerta de entrada” al intestino permeable. Zonulin abre los espacios entre las células del revestimiento intestinal. Cuando hay intestino permeable, los espacios entre las células se abren demasiado, lo que permite que moléculas de proteínas y bacterias más grandes ingresen al torrente sanguíneo, donde puede tener lugar una reacción inmunológica. A medida que aumenta el nivel de zonulina, el sello entre las células intestinales disminuye. La zonulina es el único modulador fisiológico de las uniones estrechas intercelulares descrito hasta el momento que participa en el tráfico de macromoléculas y, por tanto, en el equilibrio tolerancia/respuesta inmune.
MSA – Ensayo metagenómico en heces
Hasta hace poco, la investigación sobre la composición de la microbiota se basaba casi exclusivamente en el cultivo; Entre el 40 y el 80% de las bacterias intestinales no se pueden cultivar
La identificación de colonias puede ser difícil
Las bacterias deben estar vivas: los estudios de anaerobios son muy difíciles, grandes pérdidas durante la recogida y el procesamiento de muestras
El enfoque de cultivo puede abordar sólo una pequeña fracción de todas las especies bacterianas (¿10%?)
E. coli, que alguna vez se pensó que era una especie dominante, es un miembro menor...
R.E.D. Los científicos del laboratorio han desarrollado y validado un nuevo procedimiento para analizar poblaciones bacterianas en una muestra de heces: ensayo MSA
Nueva técnica molecular que implica la secuenciación de regiones específicas del ADN bacteriano (metagenómica)
Se puede realizar en organismos muertos (la exposición al oxígeno y la congelación no son un problema)
Identificación de cada bacteria comparando secuencias con bases de datos públicas: extremadamente precisa, no subjetiva
La tecnología de alto rendimiento permite la identificación de decenas o incluso cientos de miles de organismos en una sola muestra.
Se extrajo ADN bacteriano de muestras de heces, se realizó una amplificación por PCR en regiones del gen 16S rRNA y se secuenciaron amplicones por PCR. Las bacterias se clasificaron por filo, familia y género.

Prueba de disbiosis - prueba msa


Prevotella: fuertes productores de sulfuro de hidrógeno (H2S). En exceso, el H2S actúa como un veneno mitocondrial y un potente neurotóxico. Puede inhibir directamente las enzimas involucradas en la producción celular de energía. H2S también interfiere con el transporte de oxígeno al bloquear la hemoglobina en los glóbulos rojos. Finalmente, H2S está reduciendo el pH intestinal, lo que impide el crecimiento de muchas bacterias beneficiosas (como Bifido).
Enfoque integrativo para tbi parte 3 - disfunciones inmunitarias en tbd

MASON ET AL., TENDENCIAS EN PARASITOLOGÍA 2013; DOI:HTTPS://DOI.ORG/10.1016/J.PT.2013.12.003
Disfunción inmune en TBD

Disfunción inmune en TBD
Una característica distintiva de la enfermedad de Lyme crónica es una disfunción inmune subyacente que no solo limita la capacidad de diagnosticar Lyme con precisión, dejando a muchos de estos pacientes con un diagnóstico erróneo, sino que también sirve como una de las principales razones de la falta de respuesta al tratamiento con antibióticos, con la incapacidad de erradicar la infección crónica. .
La bacteria Borrelia (causa de la enfermedad de Lyme) se transforma de una infección aguda a una crónica al transformar el cuerpo en una respuesta dominante “extracelular” TH2 y luego pasar de una forma de espiroqueta que nada libremente en la sangre a una forma intracelular (forma L). para escapar de la elevada inmunidad TH2. La respuesta inmune intracelular TH1 suprimida y regulada a la baja se convierte en una respuesta inmune ineficaz del cuerpo y en una estrategia de evasión efectiva, que es el sello distintivo de la transformación hacia la diseminación de Lyme en etapa tardía.
Las terapias inmunomoduladoras apropiadas que sean capaces de restaurar el funcionamiento normal de la inmunidad pueden ser el mayor avance necesario en el desarrollo de un protocolo de tratamiento eficaz para esta enfermedad multisistémica.
Equilibrio TH1/TH2
Test de equilibrio TH1/TH2 basado en orina
puede detectar perturbaciones de este delicado equilibrio a tiempo para restaurarlo cuando sea necesario y antes de que se desarrollen condiciones irreversibles
permite a los pacientes hacer un seguimiento del equilibrio Th1/Th2 durante la terapia (antioxidantes, probióticos, nutracéuticos).


Pruebas de disfunciones inmunes y metabólicas.

El alcance de las disfunciones inmunes y/o metabólicas globales podría evaluarse mediante pruebas:
expresión de citoquinas
Expresión de ARNm de elastasa y perforina.
estrés oxidativo, metales pesados, mohos
actividad fagocítica de macrófagos
Actividad alfa-N-acetilgalactosaminidasa (prueba de Nagalase)
expresión sCD14
Expresión C3a y C4a
Recuento absoluto del subconjunto de células CD57
Síntesis de prostaglandina E2 (PGE2) y hsCRP.
Síntesis de VEGF
acumulación de amoníaco
acumulación de ácido quinurénico y quinolínico, y muchos más
Pruebas de disfunciones inmunes
El alcance de la disfunción inmune global se evalúa mediante pruebas:
(1) expresión de citocinas
Prueba de equilibrio Th1/Th2.
Pruebas de citocinas proinflamatorias


El alcance de la disfunción inmune global se evalúa mediante pruebas:
(2) expresión del ARNm de elastasa: un marcador de inflamación
La elastasa es una proteasa inflamatoria expresada en las células inmunitarias (monocitos, neutrófilos) que contribuye a la defensa inmunitaria inactivando bacterias extrañas pero al mismo tiempo daña el tejido conectivo, descompone las citocinas, las inmunoglobulinas y los receptores de las células inmunitarias. Por tanto, una producción excesiva y crónica de elastasa es perjudicial.Prueba del equilibrio Th1/Th2.
(3) expresión del ARNm de perforina: un medio para evaluar la activación de las células NK
Dado que las células NK desempeñan un papel central en la defensa contra bacterias y virus, la disminución de la actividad NK puede provocar el desarrollo de infecciones oportunistas. Las células NK ejercen su efecto citotóxico liberando perforina, una proteína que destruirá la membrana citoplasmática de las células diana y finalmente las matará.
El alcance de la disfunción inmune global se evalúa mediante pruebas:
(2) expresión del ARNm de elastasa: un marcador de inflamación
La elastasa es una proteasa inflamatoria expresada en las células inmunitarias (monocitos, neutrófilos) que contribuye a la defensa inmunitaria inactivando bacterias extrañas pero al mismo tiempo daña el tejido conectivo, descompone las citocinas, las inmunoglobulinas y los receptores de las células inmunitarias. Por tanto, una producción excesiva y crónica de elastasa es perjudicial.
(3) expresión del ARNm de perforina: un medio para evaluar la activación de las células NK
Dado que las células NK desempeñan un papel central en la defensa contra bacterias y virus, la disminución de la actividad NK puede provocar el desarrollo de infecciones oportunistas. Las células NK ejercen su efecto citotóxico liberando perforina, una proteína que destruirá la membrana citoplasmática de las células diana y finalmente las matará.


El alcance de la disfunción inmune global se evalúa mediante pruebas:
(4) Recuento absoluto del subconjunto de células CD57
Las células CD57+/CD3- son un subconjunto de células NK. No se comprende bien su función exacta y qué las diferencia de las células NK CD56+. El número absoluto de células CD57+/CD3- es bajo en pacientes que padecen la enfermedad de Lyme crónica (una enfermedad que sigue a una infección por una bacteria llamada Borrelia). Los pacientes con CD57 muy bajo tienen significativamente más coinfecciones y defectos inmunológicos persistentes que los pacientes con recuentos más altos. En pacientes que responden a la terapia con antibióticos, el número de células vuelve a la normalidad, por lo que es un marcador útil para seguir el efecto de una terapia.
(5) expresión de sCD14
CD14 se expresa en monocitos/macrófagos y desempeña un papel fundamental en el reconocimiento de los componentes de la pared celular bacteriana (LPS). La parte extracelular de CD14 puede escindirse y liberarse en el plasma, donde inactivará el LPS circulante. Los niveles de CD14 soluble en suero están significativamente elevados en pacientes con enfermedad inflamatoria intestinal, enfermedad de Crohn, pero también en pacientes que padecen brucelosis o enfermedad de Lyme.
El alcance de la disfunción inmune global se evalúa mediante pruebas:
(6) expresión C4A
C4a es una anafilatoxina generada por la escisión del componente 4 del complemento (C4), tras la activación del sistema del complemento. El aumento de C4a provoca una respuesta inflamatoria local y síntomas de hipersensibilidad. Un estudio estadounidense ha informado que el complemento C4a elevado era un marcador temprano de la enfermedad de Lyme en pacientes con picaduras de garrapatas. Pero los niveles de C4A disminuyen en pacientes con TBD crónico/tardío
(7) síntesis de prostaglandina E2 (PGE2)
(8) síntesis de VEGF
(9) cuantificación de CD38

Producción de Pge2 durante la enfermedad y el estrés psicológico

Cuantificación
FURUYASHIKI, T. & NARUMIYA, S. (2010) RESPUESTAS AL ESTRÉS: LA CONTRIBUCIÓN DE LA PROSTAGLANDINA E2 Y SUS RECEPTORES NAT. REV. ENDOCRINOL. DOI:10.1038/NRENDO.2010.194
Prostaglandine e2

Síntesis de prostaglandina e2 (PGE2)
PGE2 es un compuesto derivado de fosfolípidos de membrana.
PGE2 también es un mediador clave de la inmunopatología en infecciones crónicas y cáncer
La PGE2 mejora su propia producción pero suprime los mediadores inflamatorios agudos, lo que resulta en su predominio en las etapas tardías/crónicas de la inmunidad.
La PGE2 suprime selectivamente las funciones efectoras de los macrófagos y neutrófilos y la inmunidad tipo 1 mediada por células Th1, CTL y NK, pero promueve respuestas Th2, Th17 y células T reguladoras.
PGE2 modula la producción de quimiocinas, inhibiendo la atracción de células proinflamatorias al tiempo que mejora la acumulación local de células T reguladoras y células supresoras derivadas de mieloides.
Ácidos kynurénico y quinolónico


Se han identificado altos niveles de ácido kynurénico en pacientes que padecen encefalitis transmitida por garrapatas, esquizofrenia y enfermedades relacionadas con el VIH. En todas estas situaciones, los niveles aumentados se asociaron con confusión y síntomas psicóticos
QUINO actúa como neurotoxina, gliotoxina, mediador proinflamatorio, molécula prooxidante y puede alterar la integridad y cohesión de la barrera hematoencefálica. Los niveles de ácido quinolínico están aumentados en el cerebro de niños infectados con una gama de infecciones bacterianas del sistema nervioso central (CNS), en pacientes con poliovirus, enfermedad de Lyme con participación del CNS, lesiones traumáticas del CNS, hiperamonemia, pacientes con hipoglucemia, lupus eritematoso sistémico, malaria, etc.
VEGF
VEGF juega un gran papel en condiciones patológicas asociadas a enfermedades autoinmunes como en el lupus eritematoso sistémico, la artritis reumatoide y la esclerosis múltiple.
Los niveles séricos de VEGF se correlacionan con la actividad de la enfermedad en un gran número de enfermedades autoinmunes y disminuyen con el uso de terapia estándar
Posibles estrategias terapéuticas futuras en enfermedades autoinmunes con el anti-VEGF o anti-VEGFR (receptor). Hasta ahora, esta terapia se ha utilizado en el cáncer y en la degeneración macular ocular en diabetes.
Niveles anormalmente altos de VEGF en un ambiente libre de moho sugerirían una infección por Bartonella.
VEGF puede disminuir en presencia de mohos interiores.


CD38 EN TBD
CD38 en TBD (Hartiala et al. 2007, 2010)
CD38, que tiene un papel importante en la quimiotaxis de las células dendríticas (DC) y la migración a los ganglios linfáticos, fue fuertemente regulado positivamente por el LPS de las bacterias Gram, pero prácticamente no por Borrelia garinii (que induce principalmente neuroborreliosis).
Borrelia garinii puede afectar funciones cruciales de las CD al bloquear la regulación positiva de moléculas importantes en la migración de las CD a los ganglios linfáticos, afectando así más respuestas inmunes en la infección por borreliosis de Lyme (Hartiala et al. 2007, 2010).
B. burgdorferi sensu stricto and B. afzelii are also unable to induce CD38 upregulation.
Por lo tanto, niveles bajos de CD38 podrían indicar infección por Borrelia, mientras que niveles altos de CD38 podrían indicar otras infecciones por Gram y/o intestino permeable.
CD38 EN LYME

De Peacock et al. Redox Biology 2015
Enfócate en CIRS
CIRS = Síndrome de Respuesta Inflamatoria Crónica
Ritchie Shoemaker: Pionero en CIRS, moho y biotoxinas
El cuerpo adquiere biotoxinas u organismos productores de toxinas de la comida, agua, aire o picaduras de insectos
Las biotoxinas causan la producción continua y desregulada de citoquinas
Múltiples daños al cuerpo con síntomas relacionados con la inflamación, síntomas del sistema inmunológico, bacterias resistentes, dolor crónico, trastornos del sueño, problemas gastrointestinales,….
Investigación de varios marcadores del camino de biotoxinas de Shoemaker


VEGF
Citoquinas
C3A y C4A
VIP y a-MSH
MMP-9
MARCoNS
Problemas gastrointestinales
Producción de hormonas alterada
Círculo vicioso

Consequences of TBI

Recordar
Es importante tener en cuenta que el TBD puede ser agudo o tardío/persistente/crónico; Esto es importante dado que los enfoques de diagnóstico y tratamiento pueden ser diferentes en estas dos situaciones.
La enfermedad de Lyme presenta una variedad de síntomas que pueden confundirse con trastornos inmunológicos e inflamatorios.
Si una persona tiene alguna condición de salud crónica, desde artritis hasta síndrome de fatiga crónica y fibromialgia, es importante descartar o diagnosticar la enfermedad de Lyme. Es evidente que muchos casos de fibromialgia y síndrome de fatiga crónica son en realidad la enfermedad de Lyme disfrazada.
Para ofrecer un mejor tratamiento a los pacientes con infecciones tardías/crónicas y/o persistentes que son muy difíciles de descubrir, es importante centrarse en un enfoque integrador, que incluya la detección directa de patógenos, así como pruebas de apoyo indirectas centradas en el sistema inmunológico y gastrointestinal. trastornos.
Los pacientes crónicos tienen un cuadro clínico complejo con múltiples afecciones que necesitan, por lo tanto, múltiples pruebas y una interpretación cuidadosa de los resultados de las pruebas.
Conclusiones: enfoque integrador para las pruebas de enfermedades transmitidas por garrapatas
Para ofrecer un mejor manejo de los pacientes con infecciones crónicas y/o persistentes que son muy difíciles de descubrir, centrarse tanto en la detección directa de patógenos como en las pruebas de apoyo indirectas (evaluación de trastornos inmunológicos y gastrointestinales).
Pruebas directas para infecciones persistentes y/o crónicas
Prueba del fago borrelia Phelix
Inmunoblot para Borrelia, Chlamydia (neumonía, trachomatis, psittaci), Yersinia, EBV, Parvovirus, Treponema
Pruebas serológicas para CMV, Toxoplasmosis, Tularemia, Leptospira, BrucellaCapt
Prueba FISH para Babesia
PCRs para Mycoplasma spp, Mycoplasma fermentans, Mycoplasma pneumoniae, Bartonella, Brucella, Coxiella, Babesia, Anaplasma, Ehrlichia, Chlamydias, Rickettsias, Midichloria mitochondrii, etc.
PCR para infecciones virales: herpesvirus como HHV-6, HHV-7, HHV-8, Parvovirus, EBV, TBE, etc.
Pruebas de parásitos, moho, etc.
Nuevas pruebas


Pruebas indirectas para infecciones persistentes y/o crónicas
CD57 cell subset absolute count
CD38 quantification
cytokines’ expression, Th1/Th2 balance
sCD14 expression
prostaglandin E2 (PGE2) synthesis, VEGF, C4A and C3A quantification; KYNA & QUINO
Perforina y Elastasa
Evaluación de intoxicación por metales.
Especial atención a los trastornos gastrointestinales (disbiosis, intestino permeable, infecciones e inflamación intestinal, etc.)
R.E.D. Laboratories quienes somos

R.E.D. Laboratories es una empresa belga que desarrolla pruebas para enfermedades inmunológicas crónicas y disfunciones intestinales
Estamos involucrados en varios grupos internacionales con el objetivo de avanzar en el conocimiento de los marcadores biológicos del autismo.
En R.E.D. Laboratories, estamos desarrollando continuamente nuevas pruebas de acuerdo con las necesidades específicas de los proveedores de atención médica.
Todos los beneficios generados se utilizan para la investigación y el desarrollo de nuevas pruebas.
Preguntas y contactos
Referencias:
Material disponible en el sitio web (www.redlabs.com)
Revise regularmente nuestro sitio web (www.redlabs.com) para las actualizaciones
Preguntas y contacto:
Preguntas generales, logística: Correo electrónico a info@redlabs.be - Preguntas científicas: Correo electrónico a tmijatovic@redlabs.be




